Тема дипломной работы: Синтез катионных порфиринов для применения в антимикробной фотодинамической терапии
или
Заказать новую работу(фрагменты работы)
| Учебное заведение: | Московский институт тонкой химической технологии им. М.В. Ломоносова (МИТХТ) |
| Тип работы: | Дипломные работы |
| Категория: | Химия |
| Год сдачи: | 2023 |
| Количество страниц: | 59 |
| Оценка: | 5 |
| Дата публикации: | 20.03.2024 |
| Количество просмотров: | 72 |
| Рейтинг работы: |
Данная выпускная квалификационная работа включает: 59 страниц, 27 рисунков, 6 таблиц, 4 схемы. Использованных
литературных источников – 22.
Работа выполнена на кафедре ХТБАСМиОХ РТУ МИРЭА (ИТХТ им. М.В. Ломоносова).
На данный момент большое внимание уделено развитию альтернативного антибиотикам методу лечения – антимикробной фотодинамической терапии (аФДТ), которая включает в себя использование фотоактивных агентов – фотосенсибилизаторов. В качестве таких агентов широкое применение получили порфирины, к методам получения которых относится создание макроциклических структур с различными функциональными группами для придания молекулам определенных свойств.
Данная работа посвящена разработке методов синтеза катионных порфиринов, а
также изучению их физико-химических свойств. В ходе работы были получены целевые
катионные свободноосновные порфирины, а также их комплексы с Zn(II). Было исследовано их распределение в системе н-октанол/вода, имитирующей липофильные
клеточные слои и физиологические жидкости организма соответственно.
Ключевые слова: синтез, катионные порфирины, антимикробная фотодинамическая
терапия.
(фрагменты работы)
Литературный обзор
Механизмы ФДТ
Механизм ФДТ в настоящий момент хорошо изучен. Упрощенно можно сказать, что процедура включает в себя местное или внутривенное введение ФС, а после – облучение видимым/ближним инфракрасным светом с определенной длинной волны. Другим элементом в этом процессе является кислород, присутствующий в тканях.
Под действие излучения ФС в своем основном синглетном состоянии переходит в возбужденное синглетное состояние; последнее путем межсистемного перехода приводит в долгоживущему возбужденному триплетному состоянию. Такие триплетные возбужденные виды могут реагировать с субстратом и с молекулами кислорода (в их основном триплетном состоянии), присутствующими в тканях. Оба типа реакций генерируют реактивные виды кислорода: в первом случае образуются O2-, H2O2, HO-, а во втором – синглетный кислород 1O2.
Такие процессы, соответственно известные как реакции типа I и типа II, могут происходить одновременно; действие активных форм кислорода (АФК) на раковые либо бактериальные клетки приводит к клеточному повреждению и гибели. Было доказано, что реакция типа II является основной, происходящая in vivo, и, таким образом, синглетный кислород является основным видом АФК.
Чтобы аФДТ действовала, молекула ФС должна проникать через клеточные стенки микроорганизмов и связываться с плазматической мембраной микробной клетки [9]. Сродство ФС к мембране определяется его амфифильными свойствами и зависит от расположения гидрофобных и гидрофильных групп в его структуре. Однако различные мембранные барьеры бактериальной клетки могут ограничивать простую диссеминацию ФС в бактериальный цитозоль.
В 1884 году Ганс Кристиан Грам разработал метод позволяющий различать грамположительные и грамотрицательные бактерии при помощи окрашивания бактерий анилиновыми красителями и сафранином. Грамположительные бактерии окрашиваются в фиолетовый, а грамотрицательные бактерии – розовым. Это различие обусловлено составом клеточной стенки у каждого типа бактерий [10, 11].
Строение грамположительных бактерий отличается от грамотрицательных несколькими ключевыми особенностями. Внешняя мембрана, окружающая грамположительные бактерии, более проницаема для гидрофобных мелких молекул. У грамположительных микроорганизмов слой пептидогликанов может ограничить диффузию ФС в бактерии.
Грамотрицательные бактерии имеют оболочку, состоящую из трех слоев. Первый слой — это внешняя мембрана, которая содержит фосфолипиды и липополисахариды (ЛПС). Второй слой — это клеточная стенка из пептидогликана, которая представляет собой жесткий экзоскелет, определяющий форму клетки. Третий слой – внутренняя мембрана, которая представляет собой фосфолипидный бислой, отвечающий за ряд процессов, такие как структурная, транспортная и биосинтетические функции [12].
Такая структура играет ключевую роль в защите грамотрицательных бактерий от воздействий окружающей среды, создавая дополнительный стабилизирующий слой вокруг клетки. Сложнее получить высокоэффективный ФС для применения аФДТ против грамотрицательных бактерий, поскольку их клеточная стенка препятствует поглощению анионных и нейтральных ФС [13].
Практическая часть
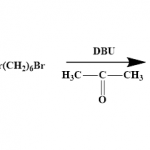
3.1.1. Синтез 3,4-[ди(6-бромгексил)окси]-бензальдегида (1a)
К раствору 1 г (7,39 ммоль) 3,4-гидроксибензальдегида и 4,42 г (18,1 ммоль) 1,6-дибромгексана в 20 мл ацетона добавляли 2,75 г (18,1 ммоль) DBU. Реакция протекала в течение 12 ч при перемешивании при комнатной температуре. Реакционную массу концентрировали под вакуумом, затем экстрагировали в системе хлористый метилен/вода с добавлением раствора соляной кислоты. Целевой продукт очищали с помощью колоночной хроматографии на силикагеле G 60. Элюировали системой хлористый метилен:гексан = 5:1. Сушили в вакууме над P2O5.
Выход 1714 мг (50%). 1Н ЯМР: (300 МГц, CDСl3, δ, м.д.): 9.83 (с, 1H, СHO), 7.42 (дд, J = 8.1, 1.9 Гц, 1H, 2-(ArH)), 7.38 (д, J = 1.9 Гц, 1H, 6-(ArH)), 6.95 (д, J = 8.1 Гц, 1H, 5-(ArH)), 4.07 (дт, J = 8.4, 6.4 Гц, 4H, ОСН2), 3.45 – 3.40 (м, 4H, СН2Br), 1.93 – 1.82 (м, 8H, ОСН2-СН2-СН2), 1.58 – 1.48 (м, 8H, СН2-СН2-СН2Br).
Похожие работы
-
40 страниц |2500 ₽
-
46 страниц |6000 ₽
-
77 страниц |600 ₽
-
1434.3 ₽
-
52 страниц |3000 ₽
-
41 страниц |2000 ₽
-
30 страниц |600 ₽
-
47 страниц |1800 ₽